ஜான் டால்ட்டன் (John Dalton) செப்டம்பர் 6, 1766 இங்கிலாந்தின் கம்பர்லேண்டில் உள்ள காக்கர்மவுத் அருகே ஈகிள்ஸ்பீல்டில் இருந்து ஒரு குவாக்கர் குடும்பத்தில் பிறந்தார். அவரது தந்தை ஒரு நெசவாளர். அவர் தனது ஆரம்ப கல்வியை தனது தந்தையிடமிருந்தும், அருகிலுள்ள கிராமமான பார்ட்ஷா ஹாலில் ஒரு தனியார் பள்ளியை நடத்தி வந்த குவாக்கர் ஜான் பிளெட்சரிடமிருந்தும் பெற்றார். டால்டனின் குடும்பம் அவரை நீண்ட காலமாக ஆதரிக்க முடியாத அளவுக்கு மோசமாக இருந்தது. மேலும் அவர் தனது பத்து வயதிலிருந்தே, பணக்கார உள்ளூர் குவாக்கர் எலிஹு ராபின்சனின் சேவையில் தனது வாழ்க்கையில் சம்பாதிக்கத் தொடங்கினார். 1800ம் ஆண்டு, தனது 34-ஆம் வயதில், மான்செஸ்டர் இலக்கிய தத்துவக் கழகத்துக்குச் செயலர் ஆனார். அங்கே, அதற்கு அடுத்த ஆண்டு, வளிமங்களின் கூறுகள், வெற்றிடத்திலும், வளிமண்டலத்திலும், வெவ்வேறு வெப்பநிலையில் நீராவி மற்றும் பிற வளிமங்களின் அழுத்தம், போன்றவை பற்றிய தனது முக்கிய ஆய்வுக் கட்டுரைகளை வெளியிட்டார்.
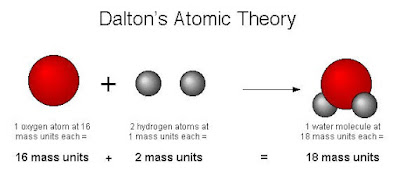
0 -100 °C (32 – 212 °F) இடைவெளியில் பல புள்ளிகளில் நீராவியின் அழுத்தத்தைக் குறித்து ஆய்வுசெய்த டால்ட்டன், மேலும் பல வித நீர்மங்களின் ஆவியழுத்தத்தையும் கவனித்து, சமமான வெப்பநிலை மாற்றத்தில், எல்லா நீர்மங்களின் ஆவியழுத்தமும் சமமாக இருக்கும் என்னும் கோட்பாட்டை முன்வைக்கிறார். டால்ட்டனின் கண்டு பிடிப்புகளிலேயே முதன்மையாகக் கருதப்படுவது வேதியலில் அணுக் கோட்பாடு என்பது தான். இருப்பினும், அவரது பெயரோடு ஆழப்பதிந்துவிட்ட கோட்பாடு எனினும், அத்தொடர்பு முழுதும் தெளிவாகப் புரிந்துகொள்ளப்படவில்லை. டால்ட்டனின் அணுக்கோட்பாட்டின் முக்கிய அம்சங்களாவன: தனிமங்கள் அனைத்தும் அணு என்னும் மிகச்சிறு துகள்களால் ஆனவை. ஒரு குறிப்பிட்ட தனிமத்தின் அணுக்கள் அனைத்தும் அச்சாக ஒரே அளவு, நிறை, பண்புகளைக் கொண்டிருக்கும். வெவ்வேறு தனிமங்களின் அணுக்கள் இவற்றிலிருந்து வேறுபட்டிருக்கும்.
அணுவை உருவாக்க முடியாது, அழிக்க முடியாது, துளைத்துப் பிரிக்கவும் முடியாது. வெவ்வேறு தனிமங்களின் அணுக்கள் முழுவெண் விகிதத்தில் கலந்து வேதிச் சேர்மம் ஆக மாறும். வேதிவினைகளில், அணுக்கள் ஒன்று சேர்ந்தோ, பிரிந்தோ, மாற்றியமைக்கப்பட்டோ விளங்கும். அணு எடைக்கான முதல் பட்டியலை வெளியிட்டார் டால்ட்டன். அதில் ஹைட்ரஜன், ஆக்சிஜன், நைட்ரஜன், கார்பன், கந்தகம், பாஸ்பரஸ் ஆகிய ஆறு தனிமங்கள் இடம்பெற்றிருந்தன. ஹட்ரஜன் அணுவிற்கு எடை 1 என்ற அனுமானத்தில் இருந்து இது கட்டமைக்கப்பட்டிருந்தது. முதன்முதலில் இதனை எவ்வாறு கண்டறிந்தார் என்பது குறித்த அதிக விவரங்கள் இல்லை. ஆனால் அவருடைய ஆய்வுக்கூடக் குறிப்பேட்டில், 1803 ஆம் ஆண்டு, செப்டம்பர் மாதம் ஆறாம் தேதி நீர், அம்மோனியா, கார்பன் டையாகசைடு ஆகிவற்றைப் பற்றிய ஆய்வையொட்டி பல அணுக்களின் எடையை கொண்ட ஒரு பட்டியல் இருக்கிறது.
அணுக் கோட்பாடு (1808) பற்றிய தனது முதல் விரிவாக்கப்பட்ட விவாதத்தில், டால்டன் கூடுதல் (சர்ச்சைக்குரிய) “மிகப் பெரிய எளிமையின் விதி” யை முன்மொழிந்தார். இந்த விதியை சுயாதீனமாக உறுதிப்படுத்த முடியவில்லை. ஆனால் சில எளிய மூலக்கூறுகளுக்கான சூத்திரங்களை முன்மொழிய இதுபோன்ற சில அனுமானங்கள் அவசியமாக இருந்தன. அதன் அடிப்படையில் அணு எடைகளின் கணக்கீடு சார்ந்து இந்த விதி இரண்டு வெவ்வேறு உறுப்புகளின் அணுக்கள் ஹைட்ரஜன் மற்றும் ஆக்ஸிஜன் உருவாக்கும் நீர் அல்லது ஹைட்ரஜன் மற்றும் நைட்ரஜன் உருவாக்கும் அம்மோனியா போன்ற ஒரே ஒரு கலவையை மட்டுமே உருவாக்குகின்றன. அந்த சேர்மத்தின் மூலக்கூறுகள் ஒவ்வொரு தனிமத்தின் ஒரு அணுவையும் கொண்டதாக கருதப்படும். அப்போது அறியப்பட்ட கார்பனின் இரண்டு ஆக்சைடுகள் அல்லது நைட்ரஜனின் மூன்று ஆக்சைடுகள் போன்ற பல விகிதங்களில் இணைந்த கூறுகளுக்கு, அவற்றின் சேர்க்கைகள் சாத்தியமான எளிமையானவை என்று கருதப்பட்டது. எடுத்துக்காட்டாக, இதுபோன்ற இரண்டு சேர்க்கைகள் தெரிந்தால், ஒன்று ஒவ்வொரு தனிமத்தின் அணுவையும் கொண்டிருக்க வேண்டும், மற்றொன்று ஒரு தனிமத்தின் ஒரு அணுவையும் மற்றொன்றின் இரண்டு அணுக்களையும் கொண்டிருக்க வேண்டும்.
இது இயற்கையின் எளிமை மீதான நம்பிக்கையிலிருந்து பெறப்பட்ட ஒரு அனுமானமாகும். ஒவ்வொரு தனிமத்தின் எத்தனை அணுக்கள் ஒன்றிணைந்து மூலக்கூறுகளை உருவாக்குகின்றன என்பதைக் கண்டறிய எந்த ஆதாரமும் விஞ்ஞானிகளுக்கு கிடைக்கவில்லை. ஆனால் இது அல்லது வேறு ஏதேனும் ஒரு விதி எந்தவொரு தொடக்கக் கோட்பாட்டிற்கும் முற்றிலும் அவசியமானது. ஏனென்றால் அணு எடைகளைக் கணக்கிடுவதற்கு ஒருவருக்கு ஒரு மூலக்கூறு சூத்திரம் தேவைப்பட்டது. டால்டனின் “மிகப் பெரிய எளிமை விதி”, தண்ணீருக்கான சூத்திரம் OH என்றும் அம்மோனியா NH என்றும், நமது நவீன புரிதலில் (H2O, NH3) இருந்து முற்றிலும் மாறுபட்டது என்றும் அவர் கருதினார். மறுபுறம், அவரது எளிமை விதி கார்பனின் இரண்டு ஆக்சைடுகளுக்கு (CO மற்றும் CO2) சரியான நவீன சூத்திரங்களை முன்மொழிய வழிவகுத்தது. டால்டனின் அணுக் கோட்பாட்டின் மையத்தில் நிச்சயமற்ற தன்மை இருந்தபோதிலும், கோட்பாட்டின் கொள்கைகள் தப்பிப்பிழைத்தன.

1794 ஆம் ஆண்டில், மான்செஸ்டருக்கு வந்த சிறிது நேரத்திலேயே, டால்டன் மான்செஸ்டர் இலக்கிய மற்றும் தத்துவ சங்கத்தின் “லிட் & பில்” உறுப்பினராக தேர்ந்தெடுக்கப்பட்டார். சில வாரங்களுக்குப் பிறகு அவர் தனது முதல் கட்டுரையை “வண்ணங்களின் பார்வை தொடர்பான அசாதாரண உண்மைகள்”, இதில் கண் பார்வையின் திரவ ஊடகத்தின் நிறமாற்றம் காரணமாக வண்ண உணர்வின் பற்றாக்குறை ஏற்பட்டது என்று அவர் குறிப்பிட்டார். அவரும் அவரது சகோதரரும் வண்ண குருடர்களாக இருந்ததால், இந்த நிலை பரம்பரை பரம்பரையாக இருக்க வேண்டும் என்பதை அவர் உணர்ந்தார். நவீன அணுக் கோட்பாட்டை முன்வைத்ததற்கும், நிறக்குருடு பற்றிய ஆய்வினாலும், வளிமங்கள், நீர்மங்கள் பற்றிய ஆய்வினாலும் நன்கு அறியப்பட்ட ஜான் டால்ட்டன் ஜுலை 27, 1844ல் தனது 77வது அகவையில் மான்செஸ்டர், லங்காஷயர், இங்கிலாந்தில் இவ்வுலகை விட்டு பிரிந்தார்.







